Detectan un gen clave que permitiría a la clamidia permanecer en el cuerpo sin ser detectada
Investigadores de la Facultad de Ciencias Químicas descubrieron uno de los posibles mecanismos por el cual la bacteria Chlamydia trachomatis entra en estado de latencia cuando se siente amenazada por las defensas del organismo o por la administración de antibióticos. Se trata de un gen cuya función hasta ahora no había sido identificada y sería el que le permite mantenerse por tiempos prolongados en el organismo eludiendo las acciones del sistema inmune y continuar con la infección. Chlamydia trachomatis es la principal causante de infecciones bacterianas de transmisión sexual. El problema es que la mayoría de los casos son asintomáticos, por lo que la infección puede persistir inadvertida durante meses y causar secuelas graves como infertilidad irreversible en mujeres, así como problemas respiratorios y conjuntivitis en los recién nacidos de madres infectadas. [02.09.2020]
Prosecretaría de Comunicación Institucional – UNC
josefinacordera@unc.edu.ar
Chlamydia trachomatis es la principal bacteria causante de infecciones de transmisión sexual bacterianas del mundo.
Como carece de síntomas –entre el 70% y el 90% de las mujeres infectadas pueden ser asintomáticas–, es difícil diagnosticarla y su persistencia en el cuerpo de las mujeres genera un daño paulatino en el aparato reproductor que puede incluso llegar hasta la infertilidad irreversible.
El impacto de las infecciones de transmisión sexual por Chlamydia trachomatis en la salud pública, a nivel global, es enorme: hay más de 130 millones de casos por año y provoca pérdidas económicas por miles de millones de dólares.
- Notas vinculadas
- Un modelo in vitro para desentrañar el mecanismo
A pesar de que se cura con antibióticos comunes administrados por vía oral (azitromicina), muchos portadores no concurren al médico y no realizan el tratamiento simplemente porque desconocen que están infectados.
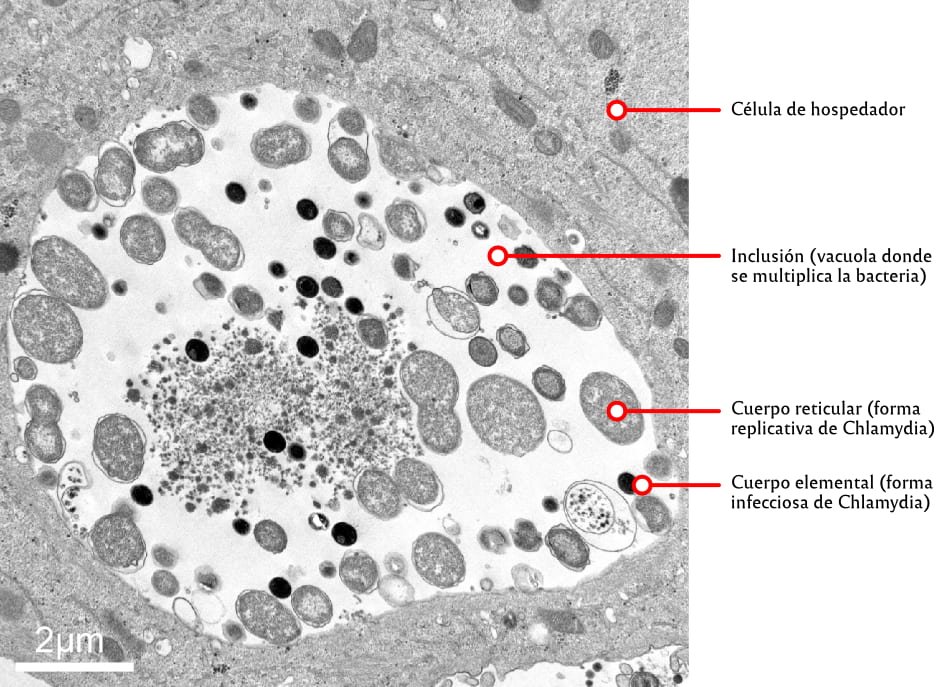
El Centro de Investigaciones en Bioquímica Clínica e Inmunología (Cibici) –de la Facultad de Ciencias Químicas de la UNC y el Conicet– es uno de los pocos institutos que trabaja con la manipulación genética de Chlamydia trachomatis para conocer el mecanismo que le permite entrar en latencia cuando se siente amenazada por las defensas del organismo.
Desde el punto de vista clínico, las infecciones por Chlamydia suelen durar mucho tiempo y en general son asintomáticas. Esto se debe a que, a nivel molecular y biológico, la bacteria tiene un mecanismo para darse cuenta de la acción de las defensas del organismo.
Cuando se ve atacada, capta el ambiente hostil, deja de multiplicarse y se “esconde”: entra en latencia o “persistencia”. Cuando esto ocurre, las defensas del sistema inmune, de a poco, bajan su intensidad. Y en ausencia de ese “ambiente hostil”, Chlamydia reactiva su ciclo de vida, se reproduce (ciclo replicativo) y continúa la infección. Por esto, la “persistencia” es considerada un fenómeno clave, dado que le permite permanecer dentro del hospedador por periodos prolongados sin ser eliminada por las defensas.
“La persistencia clamidial es fundamental para que la bacteria pueda generar la enfermedad, propagarse y dañar cada vez más células y tejidos. Si logramos interferir o desentrañar ese mecanismo, podríamos encontrar la llave para crear una estrategia que permita contrarrestar la diseminación de la bacteria”, explica Héctor Alex Saka, director de la tesis de doctorado en la que se realizó este estudio.

Un modelo in vitro para desentrañar el mecanismo
La posibilidad de entrar y salir del estado de latencia es un mecanismo regulado por genes. Para conocer exactamente cómo funciona, Emilia Panzetta, investigadora del Cibici, utilizó nuevas técnicas de manipulación genética de Chlamydia trachomatis en su tesis doctoral.
“Lo particular de Chlamydia trachomatis es que se trata de un patógeno intracelular obligado: sólo se replica dentro de la célula humana, no tiene vida libre fuera del hospedador. Por esa razón es difícil de estudiar, ya que no crece en una placa de agar como otras bacterias, sino que necesitamos generar modelos in vitro de infección de células derivadas de tejidos humanos”, explica Panzetta.
La investigadora explica que este tipo de estudios requieren una infraestructura especial, con una sala de cultivo celular. Como son más lentos y demandan mayor presupuesto, en general este tipo de trabajos son escasos. Además de las complicaciones para cultivarla, esta bacteria es muy difícil de manipular genéticamente, por lo que la función de muchos de sus genes permanece desconocida.
Para conocer más sobre la persistencia, los investigadores utilizaron técnicas avanzadas para llevar a cabo un “screening genómico” in-vitro, con el objeto de identificar los genes que utiliza Chlamydia para poder persistir frente a la acción del interferón gamma (que nuestro sistema inmune produce para intentar contrarrestar a esta bacteria) o frente a antibióticos beta-lactámicos, como la penicilina.
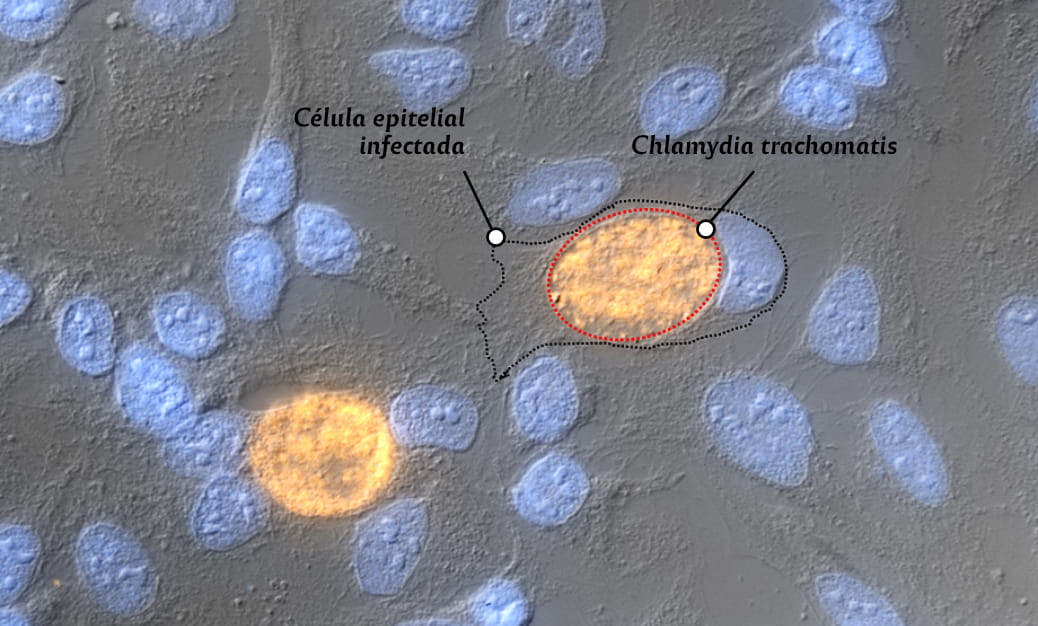
Se destaca una célula epitelial infectada y en cuyo interior se observa una gran vacuola (línea punteada roja) denominada “inclusión”, que contiene abundante cantidad de la bacteria Chlamydia trachomatis teñida en color naranja (tinción con el colorante TRITC). Además, se observa otra célula infectadas en la zona inferior izquierda.
Imagen: gentileza equipo de investigación. Aumento: 400x.
Luego, mediante nuevas técnicas de manipulación genética crearon una bacteria “mutante”, eliminando uno de genes identificados en el screening, denominado ptr. Dicho gen codifica una proteína PTR, que guarda cierta semejanza con una proteasa de Escherichia coli, pero cuya función en Chlamydia hasta ahora era desconocía. Los resultados de esta investigación permitieron descubrir que el gen ptr podría ser uno de los responsables de la latencia o persistencia de esta bacteria.
El modelo in vitro que utilizó Panzetta en su investigación replica lo que ocurriría en una persona infectada: al detectar un microorganismo agresor, las células del sistema inmune secretan interferón gamma, una molécula antimicrobiana que forma parte de las defensas del organismo.
Apenas reconoce la presencia del interferón, Chlamydia entra en estado de latencia. Aquí reside la clave de los resultados obtenidos por el equipo: mientras que una bacteria normal, es decir que contiene el gen ptr inalterado, puede salir sin problemas del periodo de latencia y continuar su ciclo reproductivo al descender los niveles de interferón, la bacteria mutante cuyo gen ptr fue anulado es incapaz de hacerlo. “Al anular el gen ptr, la bacteria pierde su capacidad de multiplicarse rápidamente luego de entrar en contacto con el interferón gamma”, sintetiza Panzetta.
Además de la identificación del gen ptr, Panzetta continúa el estudio para identificar la porción específica de la proteína PTR codificada por este gen, en la que reside la función que facilita la latencia.
Para eso, mediante ingeniería genética, generarán ahora una molécula PTR mutante, idéntica a la original pero sin el motivo conservado necesario para que la proteasa tenga su actividad.
“Las técnicas de manipulación genética en bacterias son necesarias para entender cómo funcionan, y su desarrollo en el estudio de Chlamydia trachomatis tiene apenas 10 años, es decir, es muy reciente comparado a otras bacterias como Escherichia coli. Si bien este estudio no tiene un fin terapeútico directo, genera un conocimiento básico sobre cómo logran persistir estas bacterias al infectar las células, aún en presencia de agentes antimicrobianos como el interferón gamma. Dicho conocimiento es necesario como un paso previo para el desarrollo de estrategias de prevención, como por ejemplo una vacuna, que sería la mejor alternativa frente a esta bacteria”, explica Saka.
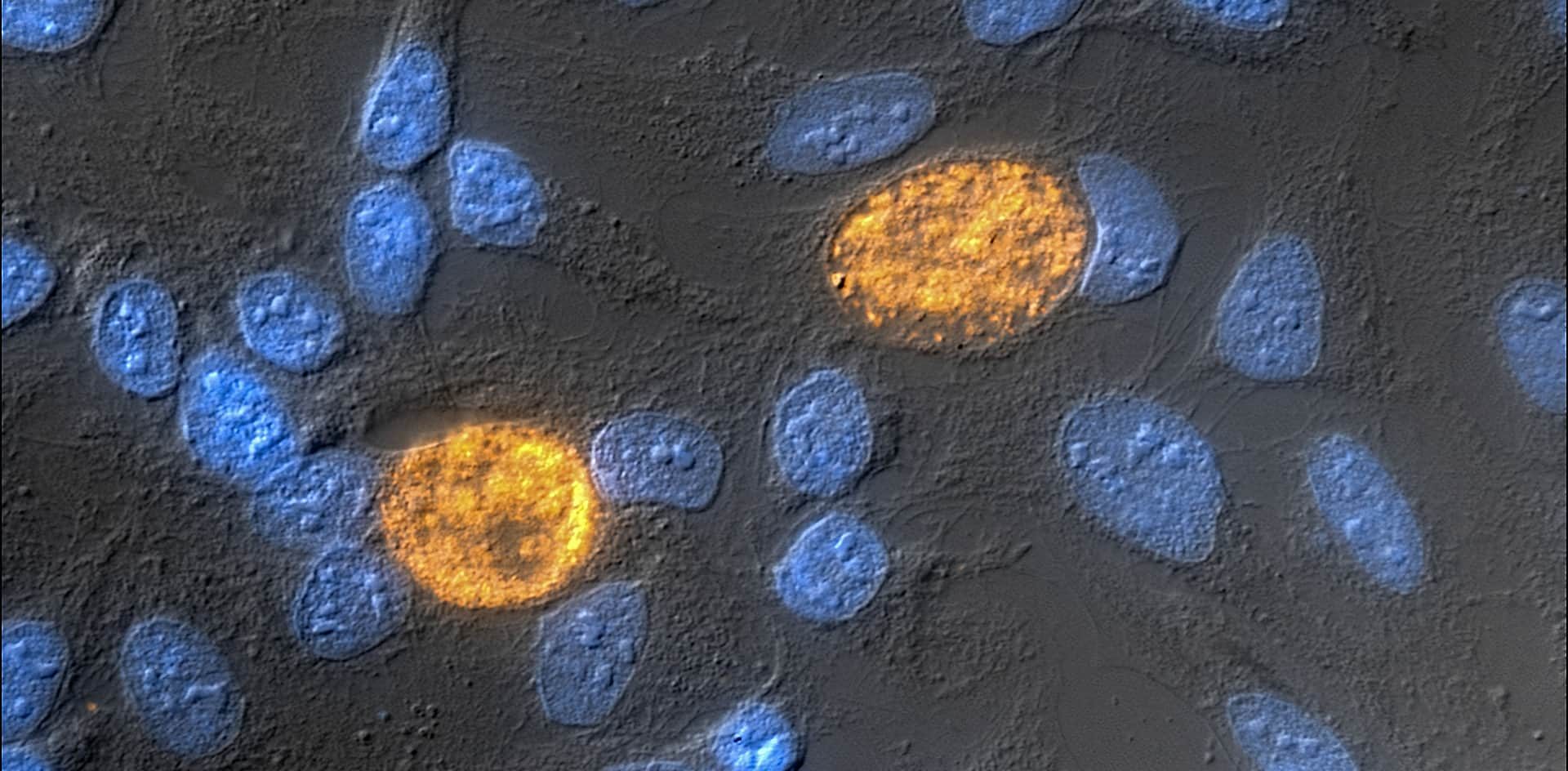
Además de la reacción frente al interferón gamma, la investigadora analizó un modelo in-vitro para conocer el comportamiento de la bacteria mutante ante antibióticos betalactámicos, como la penicilina y la amoxicilina.
“Los antibióticos betalactámicos son consumidos masivamente por la población general para tratar diversas enfermedades y se sabe que generan persistencia en Chlamydia. Las personas pueden tener clamidia asintomática y al consumir esos antibióticos por otras razones, pueden estar influyendo en la persistencia de la bacteria, de manera casual”, explica Saka.
El Cibici –apoyado por la Universidad de Duke, Estados Unidos, donde Saka realizó sus estudios de posdoctorado y Panzetta una pasantía durante su doctorado–, es uno de los pocos lugares de Latinoamérica que estudia Chlamydia a nivel molecular y aplicando técnicas de manipulación genética en este tipo de bacteria.
“Estos avances fueron posibles al trabajar de forma colaborativa con el Laboratorio de Raphael Valdivia, en Duke University. Nosotros adquirimos la tecnología para la manipulación genética de Chlamydia de tal manera de realizarla de forma independiente acá”, remarca Saka.
Ahora, el equipo de investigación estudiará otros genes que surgieron de este primer acercamiento y que podrían también estar involucrados en la persistencia.





1 Comments