Descubren que una proteína es capaz de inhibir a un agresivo gen cancerígeno

KFL6, una proteína producida por diversas células humanas, actúa frenando la acción de un importante oncogen (RAS), responsable de la producción de tumores malignos. El hallazgo fue realizado por un grupo de científicos del Centro de Investigaciones en Bioquímica Clínica e Inmunología de la Facultad de Ciencias Químicas de la Universidad Nacional de Córdoba, y publicado en la revista científica internacional Faseb Journal. A través de ensayos realizados en animales de experimentación, los científicos demostraron que KLF6 es parte de un mecanismo de protección celular capaz de contrarrestar el proceso oncogénico activado por RAS. Actualmente, están estudiando cómo se podría potenciar la acción de KLF6 en combinación con drogas utilizadas en tratamientos de quimioterapia. [18.05.2016]
Prosecretaría de Comunicación Institucional – UNC
candela.ahumada@unc.edu.ar
Los resultados de un estudio llevado a cabo por científicos del Centro de Investigaciones en Bioquímica Clínica e Inmunología (Cibici), dependiente de la UNC y el Conicet, abren nuevas posibilidades en la difícil batalla contra el cáncer. Esta vez, parte de la solución parece estar contenida dentro de las mismas células humanas: una proteína codificada por el gen KLF6 tiene la capacidad de detener los efectos de un poderoso oncogen denominado RAS (del cual hay tres variantes: H-RAS, K-RAS y N-RAS).
Así lo comprobó el grupo de científicos que llevó adelante el proyecto. Según explicaron, RAS es un oncogen “master”: su alteración genética conduce indefectiblemente a la aparición de tumores, y más del 30 por ciento de los distintos tipos de cáncer que afectan a la población humana presentan este oncogen alterado o mutado. “Es un capataz que da órdenes para que las células se dupliquen y proliferen incesantemente, provocando así el desarrollo tumoral”, grafica José Luis Bocco, investigador superior del Conicet, profesor titular de la UNC y director del proyecto del que se desprenden los resultados.
- Notas vinculadas
- Científicos cordobeses, precursores en la investigación de un supresor tumoral Administrar portlets
Sin embargo, los científicos de la UNC comprobaron que la proteína KLF6, producida por el organismo humano, puede contrarrestar la orden del capataz, deteniendo la producción de células cancerígenas.
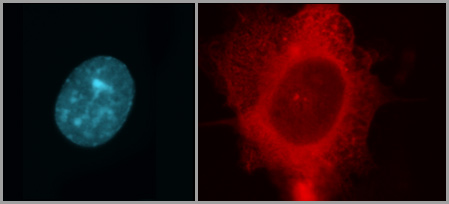
Llegaron a esta conclusión a partir de las pruebas realizadas en animales de experimentación (ratones inmunodeprimidos). Estas demostraron in vivo que cuando se inhibe la producción de KLF6, la célula se transforma y produce tumores espontáneamente. Por el contrario, si se fuerza la producción permanente de KLF6, disminuye la tumorigenicidad celular. “Vimos que los ratones a los cuales les inoculamos células cancerígenas (con RAS mutado) y la expresión forzada de la proteína KLF6, desarrollaron tumores mucho más pequeños y tardaron más tiempo en aparecer, comparados con el grupo de control”, señala Bocco.
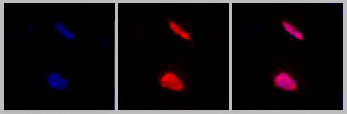
El investigador aclara que, si bien ya se conocían algunas propiedades de esta proteína como inhibidor tumoral, por primera vez demostraron que, si se anula su producción, ello provoca necesariamente la aparición de células cancerígenas, lo cual evidencia que KLF6 tiene funciones de supresor tumoral. Además encontraron que la proteína también puede regular “al capitán”, es decir, interferir en el proceso oncológico que se desencadena cuando RAS está mutado.
Las conclusiones surgen de la tesis doctoral de Lucas Trucco, realizada en el marco del proyecto de investigación “Análisis funcional del factor de transcripción KLF6 en la proliferación celular y oncogénesis”, que dirige Bocco. Las mismas fueron publicadas en la revista norteamericana FASEB Journal a fines de 2014, y premiadas por la revista internacional Biochemical Journal.
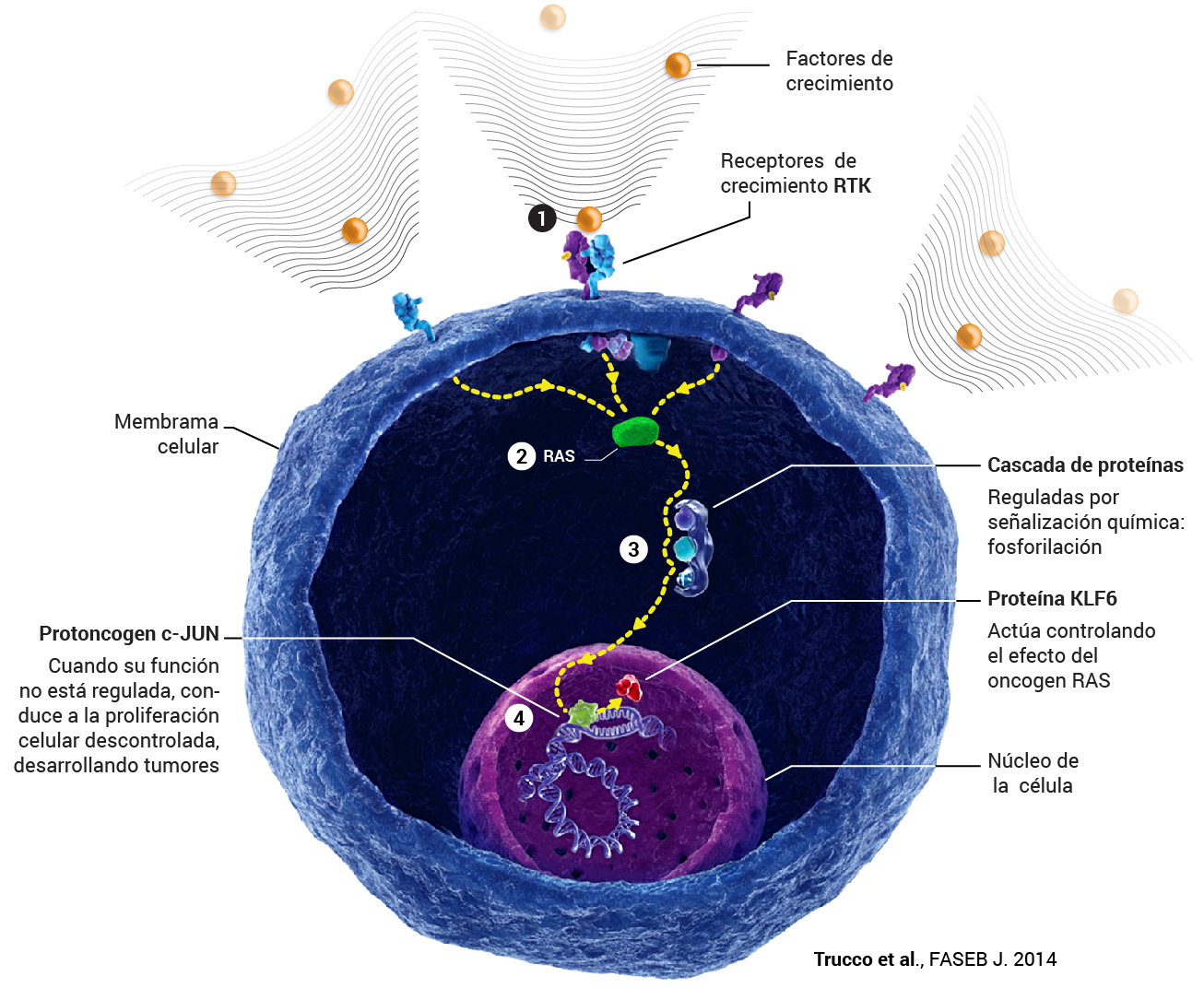
2 – RAS interpreta la señal de crecimiento y manda la orden para activar el mecanismo de proliferación o multiplicación celular.
3 – La orden transmitida por RAS pasa a través de una “cadena de obreros intermedios” (cascada de proteínas) hasta llegar a un efector final (proteína c-JUN) ubicado en el núcleo de la célula, el cual va a realizar la tarea o función biológica de multiplicación celular. La orden trasmitida por esa “cadena de obreros” se realiza por señalización bioquímica a través del proceso denominado “fosforilación”: como en una posta, un componente fosforila (enciende) a otro.
4 – La misma señal química que activa c-JUN para que inicie la proliferación celular, activa también KLF6 para que contrarreste la acción de c-Jun. Se trata de un sistema inteligente: al mismo tiempo que envía el misil (c-JUN), manda también el antimisil (KLF6) para inhibir su efecto.
Mecanismo de salvataje
Las proteínas están presentes en todas las células del cuerpo humano y son las encargadas de llevar a cabo determinadas funciones biológicas, asegurando de este modo que la célula se “especialice” en realizar tareas específicas. Muchas proteínas, como RAS, alternan su ciclo normal de actividad entre un estado activo e inactivo y, mientras trabaje a ese ritmo alternado, la célula tendrá una fisiología normal. Si ese mecanismo queda «tildado» en estado activado (por una mutación), Bocco compara el ciclo de las proteínas con el funcionamiento de un auto: “Arranca, se mueve un trecho a una velocidad determinada y luego se detiene. Pero si lo ponés a andar a alta velocidad sin detenerlo nunca, lo más probable es que tengas un accidente”.
de células tumorales
Los resultados evidencian que las células con RAS activado y la proteína KLF6 presentan un índice Ki67 mucho menor que el de las células que contenían RAS activado y otra proteína control (LacZ).
Cuando ocurren mutaciones en el oncogen RAS, este deja de tener un control cíclico de su actividad biológica, y queda tildado en la función ‘activado’, ordenando la multiplicación desenfrenada de células que conduce a la formación de tumores.
Los resultados indican que KLF6 aparece en respuesta a esa activación de RAS, con el objetivo de contrarrestar su efecto y detener la proliferación celular. “Ello evidencia que KLF6 es parte de un mecanismo de salvataje que la célula pone en marcha cuando detecta que RAS está activo”, afirma.
En este sentido, observaron que la misma señal que envía RAS ordenando la proliferación incesante de células, activa también la producción de KFL6, la cual frena el ciclo celular en determinado momento. “Vimos que la célula cancerígena comienza a reproducirse, pero se detiene en una determinada fase de su desarrollo”, apunta Bocco, quien agrega que el gran objetivo es eliminarla definitivamente. “No hay mejor célula tumoral que aquella que está muerta”, subraya.
Actualmente, los científicos estudian la aplicación de este mecanismo celular en tratamientos oncológicos a nivel experimental; específicamente, en combinación con drogas que se administran en quimioterapia. La idea es comprobar si, en combinación con la producción de KFL6, es posible requerir menor concentración de drogas, reduciendo así también los efectos colaterales. Y más aun, esperan que la acción de ambos termine eliminando las células tumorales. Un objetivo que todavía parece estar alejado.
Científicos cordobeses, precursores en la investigación de un supresor tumoral Administrar portlets
Así, los oncogenes son aquellos cuyas alteraciones causan que estén en permanente actividad o funcionamiento, mientras que los cambios en genes supresores de tumores llevan a una pérdida de la actividad de los mismos, contribuyendo así a la aparición de células cancerígenas.
Un grupo de investigadores del Cibici dirigido por el doctor Luis Patrito identificó por primera vez la proteína KLF6 en 1997. Los resultados, de repercusión internacional, fueron publicados en la revista Journal of Biological Chemistry.
Unos años después, en 2004, el equipo de investigación liderado por José Luis Bocco logró identificar un mecanismo mediante el cual la proteína KLF6 actúa como moderador negativo de la proliferación de células tumorales. ¿De qué modo? La proteína KLF6 degrada y destruye el producto del oncogen c-JUN a través del sistema de proteasoma, una especie de máquina moledora que posee la célula a la cual envía los desechos o componente que no le sirven para destruirlos. Específicamente, detectaron que la proteína KLF6 tiene la capacidad de suprimir tumores cuando actúa en interacción con otra proteína (c-JUN), producida por un oncogen. Las conclusiones de este trabajo fueron publicados tiempo atrás en la revista Oncogene.
Fecha de publicación: 18 mayo, 2016